HEXYON, suspension injectable en seringue préremplie, boîte de 1 seringue préremplie ( 2 aiguilles) de ½ mL
Retiré du marché le : 13/09/2023
Dernière révision : 04/12/2024
Taux de TVA : 2.1%
Prix de vente : 32,68 €
Taux remboursement SS : 65%
Base remboursement SS : 32,68 €
Laboratoire exploitant : SANOFI PASTEUR EUROPE
Hexyon (D-T-Polio-Ca-Hib-HepB) est indiqué chez le nourrisson, à partir de l'âge de 6 semaines pour la primovaccination et la vaccination de rappel contre la diphtérie, le tétanos, la coqueluche, l'hépatite B, la poliomyélite et les maladies invasives à Haemophilus influenzae type b (Hib).
L'utilisation de ce vaccin doit se faire conformément aux recommandations officielles.
Antécédent de réaction anaphylactique après une précédente administration d'Hexyon.
Hypersensibilité aux substances actives, à l'un des excipients mentionnés à la rubrique Liste des excipients, à des résidus à l'état de traces (glutaraldéhyde, formaldéhyde, néomycine, streptomycine et polymyxine B), à un vaccin coquelucheux, ou hypersensibilité suite à une précédente administration d'Hexyon ou d'un vaccin contenant les mêmes composants.
La
vaccination par Hexyon est contre-indiquée chez une personne ayant
présenté une encéphalopathie d'étiologie inconnue, survenue dans les 7
jours suivant l'administration d'un vaccin coquelucheux (vaccins
coquelucheux à germes entiers ou acellulaires).
Dans ce cas, la vaccination contre la coqueluche doit être interrompue
et le schéma de vaccination doit être poursuivi avec des vaccins
diphtérie, tétanos, hépatite B, poliomyélite et Hib.
Le vaccin coquelucheux ne doit pas être administré chez les sujets présentant des troubles neurologiques non contrôlés ou une épilepsie non contrôlée avant qu'un traitement n'ait été mis en place, que l'état du patient n'ait été stabilisé et que le bénéfice ne soit clairement supérieur au risque.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Hexyon ne protège pas contre
les maladies causées par des agents pathogènes autres que Corynebacterium
diphtheriae, Clostridium tetani,
Bordetella pertussis,
le virus de l'hépatite B, le virus de la poliomyélite ou Haemophilus
influenzae type b. La vaccination pourrait cependant protéger contre
l'hépatite D (causée par l'agent delta), qui ne survient pas en l'absence d'une
infection par l'hépatite B.
Hexyon ne protège pas contre les infections
hépatiques causées par d'autres agents pathogènes, telles que l'hépatite A,
l'hépatite C ou l'hépatite E, ou par d'autres agents pathogènes du foie.
Du fait de la longue période d'incubation de l'hépatite B, il est possible que l'infection non diagnostiquée soit présente au moment de la vaccination. Dans ce cas, il se peut que le vaccin ne protège pas contre l'hépatite B.
Hexyon ne protège pas contre les maladies infectieuses dues à d'autres types d'Haemophilus influenzae ou contre les méningites d'autres origines.
Avant vaccination
La vaccination doit être différée chez les personnes présentant une maladie fébrile ou une infection aiguë modérée à sévère. La présence d'une infection mineure et/ou d'une fièvre de faible intensité ne doit pas entraîner le report de la vaccination.
La vaccination doit être précédée d'une recherche des antécédents médicaux (en particulier les vaccinations précédentes et les réactions indésirables éventuelles). L'administration du vaccin Hexyon doit être envisagée avec précaution chez les personnes ayant des antécédents de réaction grave ou sévère survenue dans les 48 heures suivant l'injection d'un vaccin contenant des composants similaires.
Avant l'injection de tout médicament biologique, la personne responsable de l'administration doit prendre toutes les précautions d'usage pour la prévention des réactions allergiques ou autres. Comme pour tout vaccin injectable, un traitement médical approprié doit être disponible immédiatement et une surveillance doit être effectuée pour les cas où surviendrait une réaction anaphylactique après l'administration du vaccin.
Si l'un des
événements suivants est survenu après l'administration d'un vaccin contenant la
valence coquelucheuse, la décision d'administrer d'autres doses de vaccin
contenant la valence coquelucheuse doit être soigneusement évaluée :
· Fièvre ≥ 40°C dans les 48 heures suivant la vaccination, sans autre cause identifiable ;
· Collapsus ou état évoquant un état de choc (épisode d'hypotonie-hyporéactivité) dans les 48 heures suivant la vaccination ;
· Pleurs persistants, inconsolables, pendant une durée ≥ 3 heures, dans les 48 heures suivant la vaccination ;
· Convulsions avec ou sans fièvre, survenant dans les 3 jours suivant la vaccination.
Dans certaines circonstances (telles qu'une incidence élevée de coqueluche) les bénéfices potentiels l'emportent sur les possibles risques.
· Fièvre ≥ 40°C dans les 48 heures suivant la vaccination, sans autre cause identifiable ;
· Collapsus ou état évoquant un état de choc (épisode d'hypotonie-hyporéactivité) dans les 48 heures suivant la vaccination ;
· Pleurs persistants, inconsolables, pendant une durée ≥ 3 heures, dans les 48 heures suivant la vaccination ;
· Convulsions avec ou sans fièvre, survenant dans les 3 jours suivant la vaccination.
Dans certaines circonstances (telles qu'une incidence élevée de coqueluche) les bénéfices potentiels l'emportent sur les possibles risques.
Des antécédents de convulsions fébriles, des antécédents familiaux de convulsion ou de syndrome de mort subite du nourrisson (MSN) ne constituent pas une contre-indication à l'utilisation d'Hexyon. Les personnes vaccinées ayant des antécédents de convulsions fébriles doivent être surveillées avec attention, de tels événements indésirables pouvant survenir dans les deux à trois jours suivant la vaccination.
Chez les sujets ayant présenté un syndrome de Guillain-Barré ou une neuropathie du plexus brachial lors de l'administration antérieure d'un vaccin contenant de l'anatoxine tétanique, la décision d'administrer tout vaccin contenant de l'anatoxine tétanique doit être basée sur l'évaluation soigneuse des bénéfices et risques potentiels d'une poursuite de cette vaccination, comme par exemple que le schéma de primovaccination ait été ou non entièrement réalisé. La vaccination est habituellement justifiée chez les personnes pour lesquelles le schéma de primovaccination n'est pas complet (c'est-à- dire moins de trois doses administrées).
L'immunogénicité du vaccin peut être réduite par un traitement immunosuppresseur ou un état d'immunodéficience. Il est recommandé d'attendre la fin du traitement ou de la maladie pour vacciner. Néanmoins, la vaccination des personnes présentant une immunodéficience chronique, telle qu'une infection par le VIH, est recommandée même si la réponse immunitaire risque d'être limitée.
Populations particulières
Des données d'immunogénicité sont disponibles pour 105 prématurés. Ces
données soutiennent l'utilisation d'Hexyon chez les
prématurés. Comme attendu chez les prématurés, une réponse immunitaire plus
faible a été observée pour certains antigènes, lorsqu'elle est indirectement
comparée aux nourrissons nés à terme, bien que les niveaux de séroprotection aient été atteints (voir rubrique Propriétés
pharmacodynamiques). Aucune donnée de tolérance n'a été recueillie chez les
prématurés (naissance ≤ 37 semaines de gestation) au cours des essais
cliniques.
Le risque
potentiel d'apnée avec nécessité de surveillance respiratoire pendant 48 à 72
heures doit être soigneusement pris en compte lors de l'administration des
doses de primovaccination chez les grands prématurés (nés à 28 semaines de
grossesse ou moins) et particulièrement chez ceux ayant des antécédents
d'immaturité respiratoire. En raison du bénéfice élevé de la vaccination chez
ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Les réponses
immunitaires au vaccin n'ont pas été étudiées dans un contexte de polymorphisme
génétique.
Chez des personnes atteintes d'insuffisance rénale chronique, une réponse diminuée à la vaccination contre l'hépatite B est observée. L'administration de doses supplémentaires de vaccin de l'hépatite B doit être envisagée en fonction du taux d'anticorps contre l'antigène de surface du virus de l'hépatite B (anti HBs).
Les données d'immunogénicité chez les nourrissons exposés au VIH (infectés et non infectés) ont montré qu'Hexyon est immunogène chez la population potentiellement immunodéficiente de nourrissons exposés au VIH quel que soit leur statut VIH à la naissance (voir rubrique Propriétés pharmacodynamiques). Aucun problème spécifique de sécurité n'a été observé chez cette population.
Précautions d'emploi
Ne pas administrer par voie intravasculaire, intradermique ou sous-cutanée.
Comme tout vaccin injectable, ce vaccin doit être administré avec précaution chez les personnes présentant une thrombocytopénie ou des troubles de la coagulation, en raison du risque de saignement pouvant survenir lors de l'administration intramusculaire.
Une syncope (évanouissement), en réaction psychogène à l'injection avec une aiguille, peut survenir après, voire avant, toute vaccination. Des mesures doivent être mises en place pour prévenir toute blessure due à l'évanouissement et prendre en charge les réactions syncopales.
Interférence avec les tests de laboratoire
Du fait de l'élimination urinaire de l'antigène polyosidique capsulaire Hib, un résultat positif peut être observé lors d'un test urinaire durant 1 à 2 semaines après la vaccination. D'autres tests doivent être effectués pour confirmer une infection Hib pendant cette période.
Hexyon contient de la phénylalanine, du potassium et du sodium
Hexyon contient 85
microgrammes de phénylalanine par dose de 0,5 mL. La
phénylalanine peut être dangereuse pour les personnes atteintes de
phénylcétonurie (PCU), une maladie génétique rare caractérisée par un défaut
d'élimination de la phénylalanine et son accumulation dans le corps.
Hexyon contient moins de 1 mmol (39 mg) de potassium et moins de 1 mmol
(23 mg) de sodium par dose, c'est-à-dire qu'il est considéré comme
essentiellement « sans potassium » et « sans sodium ».
Résumé du profil de tolérance
Au cours des études cliniques conduites chez des personnes ayant reçu Hexyon, les réactions les plus fréquemment rapportées étaient la douleur au site d'injection, l'irritabilité, les pleurs et l'érythème au site d'injection. Une réactogénicité sollicitée légèrement supérieure a été observée après la première dose, par rapport aux doses suivantes.
La tolérance d'Hexyon chez les enfants de plus de 24 mois n'a pas été évaluée dans les études cliniques.
Liste tabulée des effets indésirables
La convention
suivante est utilisée pour la classification des effets indésirables :
Très fréquent
(≥ 1/10)
Fréquent (≥ 1/100, < 1/10)
Peu fréquent (≥
1/1 000, < 1/100)
Rare (≥ 1/10 000, < 1/1 000)
Très rare
(< 1/10 000)
Fréquence
indéterminée (ne peut être estimée sur la base des données disponibles)
Pour chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 1 : Effets indésirables rapportés dans les essais cliniques et lors de la surveillance post- commercialisation
| Classe de systèmes d'organes | Fréquence | Effets indésirables |
| Affections du système immunitaire | Peu fréquent | Réaction d'hypersensibilité |
| Rare | Réaction anaphylactique* | |
| Troubles du métabolisme et de la nutrition | Très fréquent | Anorexie (diminution de l'appétit) |
| Affections du système nerveux | Très fréquent | Pleurs, somnolence |
| Fréquent | Pleurs anormaux (pleurs prolongés) | |
| Rare | Convulsions avec ou sans fièvre* |
| Très rare | Réactions hypotoniques ou épisodes d'hypotonie-hyporéactivité (EHH) | |
| Affections gastro-intestinales | Très fréquent | Vomissements |
| Fréquent | Diarrhée | |
| Affections de la peau et du tissu sous-cutané | Rare | Eruption cutanée |
| Troubles généraux et anomalies au site d'administration | Très fréquent | Fièvre (≥ 38,0°C), irritabilité, douleur au site d'injection, érythème au site d'injection, œdème au site d'injection. |
| Fréquent | Induration au site d'injection | |
| Peu fréquent | Fièvre (≥ 39,6°C), nodule au site d'injection. | |
| Rare | Œdème étendu du membre† |
* Effets
indésirables rapportés spontanément
† Voir rubrique Description d'effets indésirables sélectionnés
† Voir rubrique Description d'effets indésirables sélectionnés
Description d'effets indésirables sélectionnés
Œdème étendu du membre : de larges réactions au site d'injection (> 50 mm), incluant un œdème du membre pouvant s'étendre du point d'injection à l'une ou l'autre des articulations adjacentes ont été rapportées chez l'enfant. Ces réactions apparaissent dans les 24 à 72 heures après la vaccination et peuvent être associées à des symptômes de type érythème, chaleur, sensibilité ou douleur au site d'injection. Elles disparaissent spontanément dans les 3 à 5 jours. Le risque semble être dépendant du nombre de doses de vaccin contenant la valence coquelucheuse acellulaire administrées auparavant, avec un risque accru après la 4ème dose.
Evénements indésirables potentiels
Il s’agit des événements indésirables
qui ont été rapportés avec d’autres vaccins contenant un ou plusieurs
des composants d'Hexyon, mais pas directement avec Hexyon.
Affections
du système nerveux
- Syndrome
de Guillain-Barré et neuropathie du plexus brachial ont été rapportés après
l'administration d'un vaccin contenant de l'anatoxine tétanique
- Neuropathies
périphériques (polyradiculonévrite, paralysie faciale), névrite optique,
démyélinisation du système nerveux central (sclérose en plaques) ont été
rapportées après administration d'un vaccin hépatite B
- Encéphalopathie/encéphalite
Affections respiratoires, thoraciques et médiastinales
Apnée chez les grands prématurés (nés à 28 semaines de grossesse ou moins) (voir rubrique Mises en garde spéciales et précautions d'emploi).
Troubles généraux et anomalies au site d'administration
Des réactions œdémateuses de l'un ou des deux membres inférieurs peuvent survenir après la vaccination par un vaccin contenant la valence Haemophilus influenzae type b. Ces réactions surviennent principalement après la primovaccination, dans les premières heures suivant la vaccination. Ces réactions peuvent s'accompagner de cyanose, érythème, purpura transitoire et de pleurs sévères. Ces réactions disparaissent spontanément dans les 24 heures sans séquelle.
Déclaration des effets indésirables suspectés
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du
médicament est importante. Elle permet une surveillance continue du
rapport bénéfice/risque du médicament. Les professionnels de santé
déclarent tout effet indésirable suspecté via l’Agence nationale de
sécurité du médicament et des produits de santé (Ansm) et réseau des
Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
La vaccination doit être précédée d'une recherche des antécédents médicaux (en particulier les vaccinations précédentes et les réactions indésirables éventuelles).
INTERFERENCE AVEC LES ANALYSES BIOLOGIQUES :
Du fait de l'élimination urinaire de l'antigène polyosidique capsulaire Hib, un résultat positif peut être observé lors d'un test urinaire 1 à 2 semaines après la vaccination. D'autres tests doivent être effectués pour confirmer une infection Hib pendant cette période.
CONSULTER IMMEDIATEMENT le MEDECIN si l'enfant a déjà quitté l'endroit où
il a reçu l'injection de ce vaccin et qu'il présente :
- Une difficulté à respirer.
- Une coloration bleue de la langue ou des lèvres.
- Une éruption cutanée.
- Un gonflement du visage et du cou.
- Un malaise soudain et grave avec une baisse de la pression artérielle
entraînant des sensations vertigineuses et une perte de conscience, une accélération
du rythme cardiaque associée à des troubles respiratoires.
INFORMER le médecin ou l'infirmier/ère en cas d'antécédent d'évanouissement lors d'une précédente injection pour l'enfant.
Sans objet. Le vaccin n'est pas destiné aux femmes en âge de procréer.
Hexyon peut être administré concomitamment avec un vaccin pneumococcique polyosidique conjugué, les vaccins rougeole-oreillons-rubéole, et les vaccins varicelle, les vaccins rotavirus, un vaccin méningococcique C conjugué ou un vaccin méningococcique des groupes A, C, W-135 et Y conjugué, car aucune interférence cliniquement significative sur la réponse en anticorps contre chacun des antigènes n'a été montrée.
Si une administration avec un autre vaccin est envisagée, la vaccination devra être réalisée à des sites d'injection séparés.
Hexyon ne doit pas être mélangé à aucun autre vaccin ou autre médicament administré par voie parentérale.
Aucune interaction cliniquement significative avec d'autres traitements ou produits biologiques n'a été rapportée à l'exception des traitements immunosuppresseurs (voir rubrique Mises en garde spéciales et précautions d'emploi).
Pour les interférences avec les tests de laboratoire, voir rubrique Mises en garde spéciales et précautions d'emploi.
Posologie
Primovaccination :
La primovaccination comporte 2 doses (en
respectant un intervalle d'au moins 8 semaines) ou 3 doses (en respectant un
intervalle d'au moins 4 semaines entre chaque dose) conformément aux
recommandations officielles.
Tous les calendriers vaccinaux, y compris le Programme Elargi de Vaccination (PEV) de l'OMS à 6, 10, 14 semaines peuvent être utilisés, que l'enfant ait ou non reçu une dose de vaccin de l'hépatite B à la naissance.
Si une dose de vaccin de l'hépatite B est
administrée à la naissance :
- Hexyon peut être utilisé à titre de doses supplémentaires du vaccin de l'hépatite B à partir de l'âge de 6 semaines. Si une deuxième dose de vaccin de l'hépatite B doit être administrée avant cet âge, un vaccin monovalent de l'hépatite B doit être utilisé.
- Hexyon peut être utilisé pour un schéma de vaccination mixte combinant hexavalent/pentavalent/hexavalent conformément aux recommandations officielles.
- Hexyon peut être utilisé à titre de doses supplémentaires du vaccin de l'hépatite B à partir de l'âge de 6 semaines. Si une deuxième dose de vaccin de l'hépatite B doit être administrée avant cet âge, un vaccin monovalent de l'hépatite B doit être utilisé.
- Hexyon peut être utilisé pour un schéma de vaccination mixte combinant hexavalent/pentavalent/hexavalent conformément aux recommandations officielles.
Rappel
Après une primovaccination en 2 doses avec Hexyon, une dose de rappel doit être
administrée.
Après une primovaccination en 3 doses avec Hexyon, une dose de rappel doit être
administrée.
Les doses de rappel doivent être administrées au moins 6 mois après la dernière
dose de primovaccination et conformément aux recommandations officielles. Au
minimum, une dose de vaccin Hib doit être administrée.
Par ailleurs :
En l'absence d'une vaccination contre l'hépatite B à la naissance, il est
nécessaire d'administrer une dose de rappel de vaccin de l'hépatite B. Hexyon
peut être utilisé pour la dose de rappel
Lorsqu'un vaccin de l'hépatite B est administré à la naissance, après une primovaccination en 3 doses, Hexyon ou un vaccin pentavalent D-T-Polio-Ca/Hib peut être administré comme rappel.
Hexyon peut être utilisé comme rappel chez les personnes qui ont été précédemment vaccinées à l'aide d'un autre vaccin hexavalent ou d'un vaccin pentavalent D-T-Polio-Ca/Hib associé à un vaccin monovalent de l'hépatite B.
Schéma PEV de l'OMS (6, 10, 14
semaines).
Après un schéma PEV de l'OMS, une dose de rappel doit être administrée
-
Au minimum, une dose de rappel de
vaccin poliomyélitique doit être administrée
-
en l'absence d'une vaccination
contre l'hépatite B à la naissance, une dose de rappel de vaccin de l'hépatite
B doit être administrée
-
Hexyon peut être utilisé pour la
dose de rappel
Autre
population pédiatrique
La tolérance et l'efficacité d'Hexyon chez les nourrissons de moins de 6 semaines n'ont pas été établies. Il n'y a pas de donnée disponible.
Il n'y a pas de donnée disponible chez les enfants plus âgés (voir rubriques Effets indésirables et Propriétés pharmacodynamiques)
Mode d'administration
Hexyon doit être administré par voie intramusculaire (IM). Les sites d'injection recommandés sont la partie antérolatérale du haut de la cuisse (site de préférence) chez le nourrisson ou le muscle deltoïde chez l'enfant plus âgé (possible à partir de l'âge de 15 mois).
Pour les instructions concernant la manipulation, voir la rubrique Précautions particulières d'élimination et de manipulation.
Durée de conservation :
4 ans.
Précautions particulières de conservation :
A conserver au réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
Conserver le conditionnement primaire dans l'emballage extérieur, à l'abri de la lumière.
Les données de stabilité montrent que les composants du vaccin sont stables à une température allant jusqu'à 25°C pendant une durée de 72 heures. A l'issue de cette période, Hexyon doit être utilisé ou jeté. Ces données sont destinées uniquement à orienter les professionnels de santé dans le cas d'une excursion temporaire de température.
En l'absence d'études de compatibilité, ce vaccin ne doit pas être mélangé avec d'autres vaccins ou d'autres médicaments.
Aucun cas de surdosage n'a été rapporté.
Classe pharmacothérapeutique : Vaccins, vaccins bactériens et viraux combinés, code ATC : J07CA09.
L'immunogénicité d'Hexyon chez les enfants de plus de 24 mois n'a pas été évaluée dans les études cliniques.
Les tableaux ci-dessous résument les résultats obtenus pour chacune des valences :
Tableau 1 : Taux de séroprotection/séroconversion* un mois après primovaccination avec 2 ou 3 doses d'Hexyon
| Seuils d'anticorps | Deux doses | Trois doses | |||
| 3-5 Mois | 6-10-14 Semaines | 2-3-4 Mois | 2-4-6 Mois | ||
| N=249** | N=123 à 220† | N=322†† | N=934 à 1270‡ | ||
| % | % | % | % | ||
| Anti-diphtérique (≥ 0,01 UI / mL) | 99,6 | 97,6 | 99,7 | 97,1 | |
| Anti-tétanique (≥ 0,01 UI / mL) | 100,0 | 100,0 | 100,0 | 100,0 | |
| Anti-PT (Séroconversion‡‡) (Réponse vaccinale§) | 93,4 98,4 | 93,6 100,0 | 88,3 99,4 | 96,0 99,7 | |
| Anti-FHA (Séroconversion‡‡) (Réponse vaccinale§) | 92,5 99,6 | 93,1 100,0 | 90,6 99,7 | 97,0 99,9 | |
| Anti-HBs (≥ 10 mUI / mL) | Avec vaccination hépatite B à la naissance | / | 99,0 | / | 99,7 |
| Sans vaccination hépatite B à la naissance | 97,2 | 95,7 | 96,8 | 98,8 | |
| Anti-Polio de type 1 (≥ 8 (1/dilution)) | 90,8 | 100,0 | 99,4 | 99,9 | |
| Anti-Polio de type 2 (≥ 8 (1/dilution)) | 95,0 | 98,5 | 100,0 | 100,0 | |
| Anti-Polio de type 3 (≥ 8 (1/dilution)) | 96,7 | 100,0 | 99,7 | 99,9 | |
| Anti-PRP (≥ 0,15 µg / mL) | 71,5 | 95,4 | 96,2 | 98,0 | |
* Substituts (PT, FHA) ou corrélats
de protection (autres composants) généralement acceptés. N = Nombre de
personnes analysées (dans la population per protocole)
** 3, 5 mois sans vaccination hépatite B à la naissance (Finlande, Suède)
† 6, 10, 14 semaines, avec et sans vaccination hépatite B à la naissance (Afrique du Sud)
†† 2, 3, 4 mois sans vaccination hépatite B à la naissance (Finlande)
‡ 2, 4, 6 mois sans vaccination hépatite B à la naissance (Argentine, Mexique, Pérou) et avec vaccination hépatite B à la naissance (Costa Rica et Colombie)
‡‡ Séroconversion : augmentation par un facteur ≥ 4 comparée au taux avant vaccination (pré-dose 1)
§ Réponse vaccinale : Si la concentration en anticorps avant la vaccination était < 8 UE / mL, alors la concentration en anticorps après vaccination devait être ≥ 8 UE / mL. Sinon, la concentration en anticorps après vaccination devait être ≥ au taux avant immunisation.
** 3, 5 mois sans vaccination hépatite B à la naissance (Finlande, Suède)
† 6, 10, 14 semaines, avec et sans vaccination hépatite B à la naissance (Afrique du Sud)
†† 2, 3, 4 mois sans vaccination hépatite B à la naissance (Finlande)
‡ 2, 4, 6 mois sans vaccination hépatite B à la naissance (Argentine, Mexique, Pérou) et avec vaccination hépatite B à la naissance (Costa Rica et Colombie)
‡‡ Séroconversion : augmentation par un facteur ≥ 4 comparée au taux avant vaccination (pré-dose 1)
§ Réponse vaccinale : Si la concentration en anticorps avant la vaccination était < 8 UE / mL, alors la concentration en anticorps après vaccination devait être ≥ 8 UE / mL. Sinon, la concentration en anticorps après vaccination devait être ≥ au taux avant immunisation.
Tableau 2 : Taux de séroprotection/séroconversion* un mois après la vaccination de rappel avec Hexyon
| Seuils d'anticorps | Rappel à 11-12 mois après un schéma de primo- vaccination en 2 doses | Rappel au cours de la deuxième année de vie après un schéma de primovaccination en trois doses | |||
| 3-5 Mois | 6-10-14 Semaines | 2-3-4 Mois | 2-4-6 Mois | ||
| N=249** | N=204† | N=178†† | N=177 à 396‡ | ||
| % | % | % | % | ||
| Anti-diphtérique (≥ 0,1 UI / mL) | 100,0 | 100,0 | 100,0 | 97,2 | |
| Anti-tétanique (≥ 0,1 UI / mL) | 100,0 | 100,0 | 100,0 | 100,0 | |
| Anti-PT (Séroconversion‡‡) (Réponse vaccinale§) | 94,3 98,0 | 94,4 100,0 | 86,0 98,8 | 96,2 100,0 | |
| Anti-FHA (Séroconversion‡‡) (Réponse vaccinale§) | 97,6 100,0 | 99,4 100,0 | 94,3 100,0 | 98,4 100,0 | |
| Anti-HBs (≥ 10 mUI / mL) | Avec vaccination hépatite B à la naissance | / | 100,0 | / | 99,7 |
| Sans vaccination hépatite B à la naissance | 96,4 | 98,5 | 98,9 | 99,4 | |
| Anti-Polio de type 1 (≥ 8 (1/dilution)) | 100,0 | 100,0 | 98,9 | 100,0 | |
| Anti-Polio de type 2 (≥ 8 (1/dilution)) | 100,0 | 100,0 | 100,0 | 100,0 | |
| Anti-Polio de type 3 (≥ 8 (1/dilution)) | 99,6 | 100,0 | 100,0 | 100,0 | |
| Anti-PRP (≥ 1,0 µg / mL) | 93,5 | 98,5 | 98,9 | 98,3 | |
* Substituts (PT, FHA) ou corrélats
de protection (autres composants) généralement acceptés. N = Nombre de
personnes analysées (dans la population per protocole)
** 3, 5 mois sans vaccination hépatite B à la naissance (Finlande, Suède)
† 6, 10, 14 semaines, avec et sans vaccination hépatite B à la naissance (Afrique du Sud)
†† 2, 3, 4 mois sans vaccination hépatite B à la naissance (Finlande)
‡ 2, 4, 6 mois sans vaccination hépatite B à la naissance (Mexique) et avec vaccination hépatite B à la naissance (Costa Rica et Colombie)
‡‡ Séroconversion : augmentation par un facteur ≥ 4 comparée au taux avant vaccination (pré-dose 1)
§ Réponse vaccinale : Si la concentration en anticorps avant la vaccination (pré-dose 1) était < 8 UE / mL, alors la concentration en anticorps après rappel devait être ≥ 8 UE / mL. Sinon, la concentration en anticorps après rappel devait être ≥ celle avant vaccination (pré-dose 1).
** 3, 5 mois sans vaccination hépatite B à la naissance (Finlande, Suède)
† 6, 10, 14 semaines, avec et sans vaccination hépatite B à la naissance (Afrique du Sud)
†† 2, 3, 4 mois sans vaccination hépatite B à la naissance (Finlande)
‡ 2, 4, 6 mois sans vaccination hépatite B à la naissance (Mexique) et avec vaccination hépatite B à la naissance (Costa Rica et Colombie)
‡‡ Séroconversion : augmentation par un facteur ≥ 4 comparée au taux avant vaccination (pré-dose 1)
§ Réponse vaccinale : Si la concentration en anticorps avant la vaccination (pré-dose 1) était < 8 UE / mL, alors la concentration en anticorps après rappel devait être ≥ 8 UE / mL. Sinon, la concentration en anticorps après rappel devait être ≥ celle avant vaccination (pré-dose 1).
Réponses immunitaires aux antigènes Hib et pertussiques après 2 doses à l'âge de 2 et 4 mois
Les réponses immunitaires aux
antigènes Hib (PRP) et pertussiques (PT et FHA) ont été évaluées après
2 doses au sein d'un sous-groupe de sujets ayant reçu Hexyon (N=148) à
l'âge de 2, 4, 6 mois. Les réponses immunitaires aux antigènes PRP, PT
et FHA un mois après 2 doses administrées à l'âge de 2 et 4 mois
étaient similaires à celles observées un mois après 2 doses de
primovaccination administrées à l'âge de 3 et 5 mois :
- des titres anti-PRP ≥ 0,15 µg / mL ont été observés chez 73,0 % des sujets,
- une réponse vaccinale anti-PT chez 97,9 % des sujets,
- une réponse vaccinale anti-FHA chez 98,6 % des sujets.
Persistance de la réponse immunitaire
Les études de persistance à long terme des anticorps induits par le vaccin après différents schémas de primovaccination chez le nourrisson, avec ou sans vaccination hépatite B à la naissance, ont démontré le maintien de niveaux d'anticorps au-dessus des niveaux ou seuils reconnus comme protecteurs pour les antigènes du vaccin (voir Tableau 3).
Tableau 3 : Taux de séroprotectiona à l'âge de 4,5 ans après la vaccination avec Hexyon
| Seuils d'anticorps | Primovaccination à 6-10-14 semaines et rappel à 15-18 mois | Primovaccination à 2-4-6 mois et rappel à 12-24 mois | |
| Sans vaccination hépatite B à la naissance | Avec vaccination hépatite B à la naissance | Avec vaccination hépatite B à la naissance | |
| N=173b | N=103b | N=220c | |
| % | % | % | |
| Anti-diphtérique (≥ 0,01 UI / mL) (≥ 0,1 UI / mL) | 98,2 75,3 | 97 64,4 | 100 57,2 |
| Anti-tétanique (≥ 0,01 UI / mL) (≥ 0,1 UI / mL) | 100 89,5 | 100 82,8 | 100 80,8 |
| Anti-PTe (≥ 8 UE / mL) | 42,5 | 23,7 | 22,2 |
| Anti-FHAe (≥ 8 UE / mL) | 93,8 | 89,0 | 85,6 |
| Anti-HBs (≥ 10 mUI / mL) | 73,3 | 96,1 | 92,3 |
| Anti-Polio type 1 (≥ 8 (1/dilution)) | NAd | NAd | 99,5 |
| Anti-Polio type 2 (≥ 8 (1/dilution)) | NAd | NAd | 100 |
| Anti-Polio type 3 (≥ 8 (1/dilution)) | NAd | NAd | 100 |
| Anti-PRP (≥ 0.15 µg / mL) | 98,8 | 100 | 100 |
N = Nombre de personnes analysées (dans la population per protocole)
a: Substituts (PT, FHA) ou corrélats de protection (autres composants) généralement acceptés b: 6, 10, 14 semaines, avec et sans vaccination hépatite B à la naissance (Afrique du Sud)
c: 2, 4, 6 mois avec vaccination hépatite B à la naissance (Colombie)
d: En raison de Journées Nationales de Vaccination contre la Polio avec le Vaccin Polio Oral dans le pays, les résultats Polio n'ont pas été analysés.
e: 8 UE/mL correspond à 4 LIDQ (Limite Inférieure De Quantification de l'essai immuno-enzymatique ELISA)
La valeur de la LIDQ pour anti-PT et anti-FHA est de 2 UE / mL
a: Substituts (PT, FHA) ou corrélats de protection (autres composants) généralement acceptés b: 6, 10, 14 semaines, avec et sans vaccination hépatite B à la naissance (Afrique du Sud)
c: 2, 4, 6 mois avec vaccination hépatite B à la naissance (Colombie)
d: En raison de Journées Nationales de Vaccination contre la Polio avec le Vaccin Polio Oral dans le pays, les résultats Polio n'ont pas été analysés.
e: 8 UE/mL correspond à 4 LIDQ (Limite Inférieure De Quantification de l'essai immuno-enzymatique ELISA)
La valeur de la LIDQ pour anti-PT et anti-FHA est de 2 UE / mL
La
persistance des réponses immunitaires contre le composant hépatite B
d'Hexyon a été évaluée chez des nourrissons primovaccinés à partir de
deux schémas différents.
Après une primovaccination de 2 doses des nourrissons à l'âge de 3 et 5
mois sans hépatite B à la naissance, suivie d'un rappel à l'âge de
11-12 mois, 53,8 % des enfants étaient séroprotégés (anti- HBsAg ≥ 10
mUI / mL) à l'âge de 6 ans, et 96,7 % ont présenté une réponse
anamnestique après l'administration d'une dose supplémentaire de vaccin
monovalent de l'hépatite B.
Après une primovaccination d'une dose de vaccin de l'hépatite B
administrée à la naissance suivie d'une série de 3 doses chez les
nourrissons à l'âge de 2, 4 et 6 mois et pas de rappel , 49,3 % des
enfants vaccinés étaient séroprotégés (anti-HBsAg ≥ 10 mUI / mL) à 9
ans, et 92,8 % ont présenté une réponse anamnestique après
l'administration d'une dose supplémentaire de vaccin monovalent de
l'hépatite B.
Ces données soutiennent une persistance de la mémoire immunitaire induite chez les nourrissons primovaccinés avec Hexyon.
Réponses immunitaires à Hexyon chez les prématurés
Les
réponses immunitaires aux antigènes d'Hexyon chez 105 prématurés (nés
après une période de gestation de 28 à 36 semaines) dont 90 nourrissons
nés de femmes vaccinées avec un vaccin dTca pendant leur grossesse et
15 nourrissons nés de femmes non vaccinées pendant leur grossesse, ont
été évaluées après un schéma de primovaccination de 3 doses à l'âge de
2, 3 et 4 mois et d'une dose de rappel à l'âge de13 mois.
Un mois après la primovaccination, tous les sujets étaient séroprotégés
contre la diphtérie (≥ 0,01 UI / mL), le tétanos (≥ 0,01 UI / mL) et
les types 1, 2 et 3 de poliovirus (≥ 8 (1/dilution)) ; 89,8 % des
sujets étaient séroprotégés contre l'hépatite B (≥ 10 UI / mL) et 79,4
% étaient séroprotégés contre les maladies invasives à Hib (≥ 0,15 µg /
mL).
Un mois après la dose de rappel, tous les sujets étaient séroprotégés
contre la diphtérie (≥ 0,1 UI / mL), le tétanos (≥ 0,1 UI / mL) et les
types 1, 2 et 3 de poliovirus (≥ 8 (1/dilution)) ; 94,6 % des sujets
étaient séroprotégés contre l'hépatite B (≥ 10 UI / mL) et 90,6 %
étaient séroprotégés contre les maladies invasives de Hib (≥ 1 µg / mL).
En ce qui concerne la coqueluche, un mois après la primovaccination,
98,7 % et 100 % des sujets ont développé des anticorps ≥ 8 EU / mL
contre les antigènes PT et FHA respectivement. Un mois après la dose de
rappel, 98,8 % des sujets ont développé des anticorps ≥ 8 EU / mL
contre les antigènes PT et FHA. Les concentrations d'anticorps contre
la coqueluche ont été multipliées par 13 après la primovaccination et
de 6 à 14 fois après la dose de rappel.
Réponses immunitaires à Hexyon chez les nourrissons exposés au VIH
Les
réponses immunitaires aux antigènes d'Hexyon chez 51 nourrissons
exposés au VIH (9 infectés et 42 non infectés) ont été évaluées après
un schéma de primo-vaccination à 3 doses à l'âge de 6, 10 et 14
semaines et d'une dose de rappel à l'âge de 15 mois à 18 mois.
Un mois après la primo-vaccination, tous les nourrissons étaient
séroprotégés contre la diphtérie (≥ 0,01 UI / mL), le tétanos (≥ 0,01
UI / mL), les types 1, 2 et 3 de poliovirus (≥ 8 (1/dilution)),
l'hépatite B (≥ 10 UI) / mL), et plus de 97,6 % contre les maladies
invasives à Hib (≥ 0,15 µg / mL).
Un mois après la dose de rappel, tous les sujets étaient séroprotégés contre la diphtérie (≥ 0,1 UI / mL), le tétanos (≥ 0,1 UI / mL), les types 1, 2 et 3 de poliovirus (≥ 8 (1/dilution), l'hépatite B (≥ 10 UI / mL) et plus de 96,6% contre les maladies invasives à Hib (≥ 1 µg / mL).
En ce qui concerne la coqueluche, un mois après la primo-vaccination, 100 % des sujets ont développé des anticorps ≥ 8 EU / mL contre les antigènes PT et FHA. Un mois après la dose de rappel, 100 % des sujets ont développé des anticorps ≥ 8 EU / mL contre les antigènes PT et FHA. Les taux de séroconversion définie comme une augmentation par un facteur ≥ 4 comparée au taux avant vaccination (pré-dose 1) étaient de 100 % pour les anti-PT et anti-FHA dans le groupe exposé au VIH et infecté, et de 96,6 % pour les anti-PT et 89,7 % pour les anti-FHA dans le groupe exposé au VIH et non infecté.
Réponses immunitaires à Hexyon chez les nourrissons nés de femmes vaccinées avec un vaccin dTca pendant la grossesse
Les
réponses immunitaires aux antigènes d'Hexyon chez 109 nourrissons nés à
terme et chez les 90 prématurés, nés de femmes vaccinées avec le vaccin
dTca pendant leur grossesse (entre 24 et 36 semaines de gestation) ont
été évaluées après un schéma de primovaccination à 3 doses à l'âge de
2, 3 et 4 mois et d'une dose de rappel à l'âge de 13 mois (prématurés)
ou à l'âge 15 mois (nourrissons nés à terme).
Un mois après la primovaccination, tous les sujets étaient séroprotégés
contre la diphtérie (≥ 0,01 UI / mL), le tétanos (≥ 0,01 UI / mL) et
les types 1 et 3 de poliovirus (≥ 8 (1/dilution)) ; 97,3 % des sujets
étaient séroprotégés contre le type 2 de poliovirus (≥ 8 (1/dilution))
; 94,6 % des sujets étaient séroprotégés contre l'hépatite B (≥ 10 UI /
mL) et 88,0 % étaient séroprotégés contre les maladies invasives de Hib
(≥ 0,15 µg/ mL).
Un mois après la dose de rappel, tous les sujets étaient séroprotégés
contre la diphtérie (≥ 0,1 UI / mL), le tétanos (≥ 0,1 UI / mL) et les
types 1, 2 et 3 de poliovirus (≥ 8 (1/dilution)) ; 93,9 % des sujets
étaient séroprotégés contre l'hépatite B (≥ 10 UI/ mL) et 94,0 %
étaient séroprotégés contre les maladies invasives à Hib (≥ 1 µg / mL).
En ce qui concerne la coqueluche, un mois après la primovaccination,
99,4 % et 100 % des sujets ont développé des anticorps ≥ 8 EU / mL
contre les antigènes PT et FHA respectivement. Un mois après la dose de
rappel, 99,4 % des sujets ont développé des anticorps ≥ 8 EU / mL
contre les antigènes PT et FHA. Les concentrations d'anticorps contre
la coqueluche ont été multipliées par 5 à 9 après la primovaccination
et de 8 à 19 fois après la dose de rappel.
Efficacité vaccinale et efficacité sur le terrain contre la coqueluche
L'efficacité
vaccinale des antigènes coquelucheux acellulaires (Ca) contenus dans
Hexyon contre la forme la plus sévère de coqueluche caractéristique
telle que définie par l'OMS (≥ 21 jours de toux paroxystique), est
documentée dans une étude randomisée en double aveugle conduite chez
des nourrissons ayant reçu une primovaccination en trois doses avec un
vaccin DTCa dans un pays hautement endémique (le Sénégal). Cette étude
a mis en évidence la nécessité d'une dose de rappel chez le jeune
enfant.
La capacité des antigènes coquelucheux acellulaires (Ca) contenus dans
Hexyon à diminuer à long terme l'incidence de la coqueluche et à
contrôler la maladie a été démontrée dans le cadre d'une étude
nationale de surveillance des cas de coqueluche menée en Suède avec le
vaccin pentavalent D-T- Polio-Ca/Hib administré selon un schéma 3, 5,
12 mois. Les résultats à long terme ont démontré une réduction
spectaculaire de l'incidence de la coqueluche après la deuxième dose
quel que soit le vaccin utilisé.
Efficacité sur le terrain contre les infections invasives à Hib
L'efficacité sur le terrain des vaccins combinés DTCa et Hib (pentavalents et hexavalents, dont les vaccins contenant l'antigène Hib d'Hexyon) contre les infections invasives à Hib a été démontré dans le cadre d'une large étude de surveillance post-marketing menée en Allemagne (suivi de plus de cinq ans). L'efficacité vaccinale était de 96,7 % en primovaccination et de 98,5 % en rappel (quel que soit le schéma de primovaccination).
Aucune étude de pharmacocinétique n'a été menée.
Sans objet.
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée et de tolérance locale n'ont pas révélé de risque particulier pour l'homme.
Des modifications inflammatoires histologiques chroniques ont été observées au site d'injection. En général, elles guérissent lentement.
Hexyon en seringues préremplies
Avant administration, agiter la seringue préremplie jusqu'à obtention d'une suspension trouble, blanchâtre, homogène.
Préparation et administration
La seringue contenant la suspension injectable doit être inspectée visuellement avant administration. En cas de présence de particules étrangères, de fuite, d'activation prématurée du piston ou d'embout défectueux, jeter la seringue préremplie.
La seringue est destinée à un usage unique et ne doit pas être réutilisée.
Instructions d'utilisation pour la seringue préremplie Luer lock
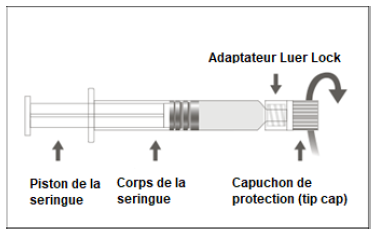
Figure A : seringue Luer Lock avec un capuchon de protection (tip cap) rigide
| Etape 1 :En tenant l'adaptateur Luer Lock d'une main (éviter de tenir le piston ou le corps de la seringue), dévisser le capuchon de protection (tip cap) en le tournant. | 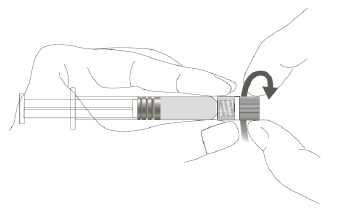 |
| Etape 2 :Pour fixer l'aiguille à la seringue, visser doucement l'aiguille à l'adaptateur Luer Lock jusqu'à sentir'une légère résistance. |  |
Instructions d'utilisation de l'aiguille sécurisée avec la seringue préremplie Luer Lock
| Figure B : Aiguille sécurisée (à l'intérieur de la coque) | Figure C : Composants de l'aiguille sécurisée (préparée pour l'utilisation) |
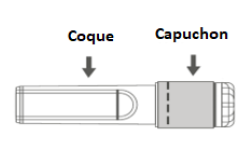 |  |
Suivre les étapes 1 et 2 ci-dessus pour préparer la seringue Luer Lock et la fixation de l'aiguille.
| Étape 3 : Retirer la coque de l'aiguille sécurisée en tirant tout droit. L'aiguille est recouverte par le bouclier de sécurité et le protège-aiguille.Étape 4 :A : soulever le bouclier de sécurité en l'écartant de l'aiguille et en le poussant vers le corps de la seringue selon l'angle indiqué.B : Retirez le protège-aiguille en tirant tout droit. | 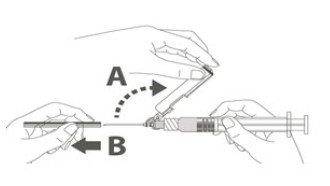 |
| Étape 5 : Une fois l'injection terminée, verrouiller (activer) avec une seule main le bouclier de sécurité à l'aide de l'une des trois (3) techniques illustrées : activation à l'aide d'une surface, du pouce ou de l'index.Remarque : L'activation est vérifiée par un « clic » sonore et/ou tactile. | 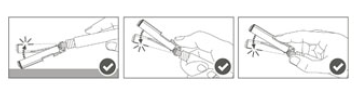 |
| Étape 6: Inspecter visuellement l'activation du bouclier de sécurité. Le bouclier de sécurité doit être entièrement verrouillé (activé), comme indiqué sur l'image C.Remarque : Lorsqu'il est entièrement verrouillé (activé), l'aiguille doit faire un angle avec le bouclier de sécurité. | 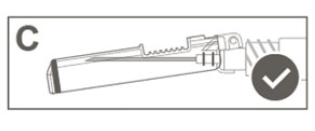 |
| L'image D indique que le bouclier de sécurité n'est PAS complètement verrouillé (non activé). | 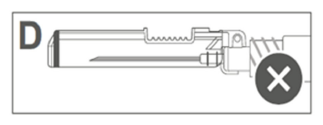 |
Attention : Ne pas essayer de déverrouiller (désactiver) le dispositif de sécurité en forçant l'aiguille à sortir du bouclier de sécurité.
Hexyon en flacons
Le flacon est destiné à un usage unique et ne doit pas être réutilisé.
Avant administration, agiter le flacon jusqu'à obtention d'une suspension trouble, blanchâtre, homogène.
La suspension doit être inspectée visuellement avant l'administration. Dans l'éventualité où l'on observerait des particules étrangères et/ou une modification de l'aspect physique, éliminer le flacon.
Prélever une dose de 0,5 mL en utilisant une seringue pour injection.
Élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Suspension injectable.
Hexyon est une suspension blanchâtre, trouble.
0,5 mL de suspension en seringue préremplie (verre de type I) munie d'un bouchon-piston (halobutyle) et d'un adaptateur Luer lock avec un capuchon de protection (halobutyle + polypropylène).
Boîte de 1 seringue préremplie avec aiguilles séparées.
Une dose1 (0,5 mL) contient :
Anatoxine
diphtérique
pas moins de 20 UI2,4 (30 Lf)
Anatoxine
tétanique
pas moins de 40 UI3,4 (10 Lf)
Antigènes de Bordetella pertussis
Anatoxine
pertussique
25 microgrammes
Hémagglutinine
filamenteuse
25 microgrammes
Virus poliomyélitique (Inactivé)5
Type 1
(Mahoney)
29 Unités d'antigène D6
Type 2
(MEF-1)
7 Unités d'antigène D6
Type 3
(Saukett)
26 Unités d'antigène D6
Antigène de surface de l'hépatite B7
10 microgrammes
Polyoside d'Haemophilus influenzae type
b
12 microgrammes
(Phosphate de Polyribosyl Ribitol)
conjugué à la protéine
tétanique
22-36 microgrammes
1 Adsorbée sur hydroxyde d'aluminium, hydraté (0,6 mg Al3+)
2 Comme limite inférieure de confiance (p = 0,95) et pas moins de 30 UI comme valeur moyenne
3 Comme limite inférieure de confiance (p= 0,95)
4 Ou activité équivalente déterminée par une évaluation de l'immunogénicité
5 Cultivé sur cellules Vero
6 Ces quantités
d'antigène sont strictement les mêmes que celles précédemment exprimées
en unité d'antigène D 40-8-32, pour les virus de type 1, 2 et 3
respectivement, lorsqu'elles sont mesurées selon une autre méthode
immunochimique appropriée
7 Produit sur cellules de levure Hansenula polymorpha selon une technologie d'ADN recombinant
Ce vaccin peut contenir des traces de glutaraldéhyde, de formaldéhyde, de néomycine, de streptomycine et de polymyxine B, utilisés au cours du procédé de fabrication (voir rubrique Contre-indications).
Excipient à effet notoire
Phénylalanine…............. 85 microgrammes
(Voir rubrique Mises en garde spéciales et précautions d'emploi)
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Phosphate disodique
Phosphate monopotassique
Trométamol
Saccharose
Acides aminés essentiels dont la L-phénylalanine
Hydroxyde de sodium, acide acétique ou acide chlorhydrique (pour ajustement du pH)
Eau pour préparations injectables
Pour l'adsorbant : voir rubrique Composition qualitative et quantitative.